Die Rolle der Darmgesundheit wird häufig unterschätzt – dabei beeinflusst sie weit mehr als nur den Magen-Darm-Trakt. Gerade bei MS, aber auch bei anderen Autoimmunerkrankungen, finden sich typische Veränderungen der Mikrobiota und ihrer Stoffwechselprodukte. Weniger entzündungshemmende Bakterien, mehr Immunaktivierung – dieses Muster scheint krankheitsübergreifend relevant zu sein. Wenn wir den Darm als Teil des Immunsystems begreifen, eröffnet sich eine neue therapeutische Perspektive, die aus unserer Sicht bislang viel zu wenig beachtet wurde.
Ein aktuelles Review von Zeng und Kollegen [1] analysiert systematisch die Rolle der Darmmikrobiota bei Autoimmun- und Entzündungserkrankungen – und ordnet auch die Multiple Sklerose in dieses immunologische Gesamtbild ein. Das hat Konsequenzen – nicht nur für zukünftige Therapiekonzepte, sondern auch für den selbstbestimmten Umgang mit MS im Alltag.
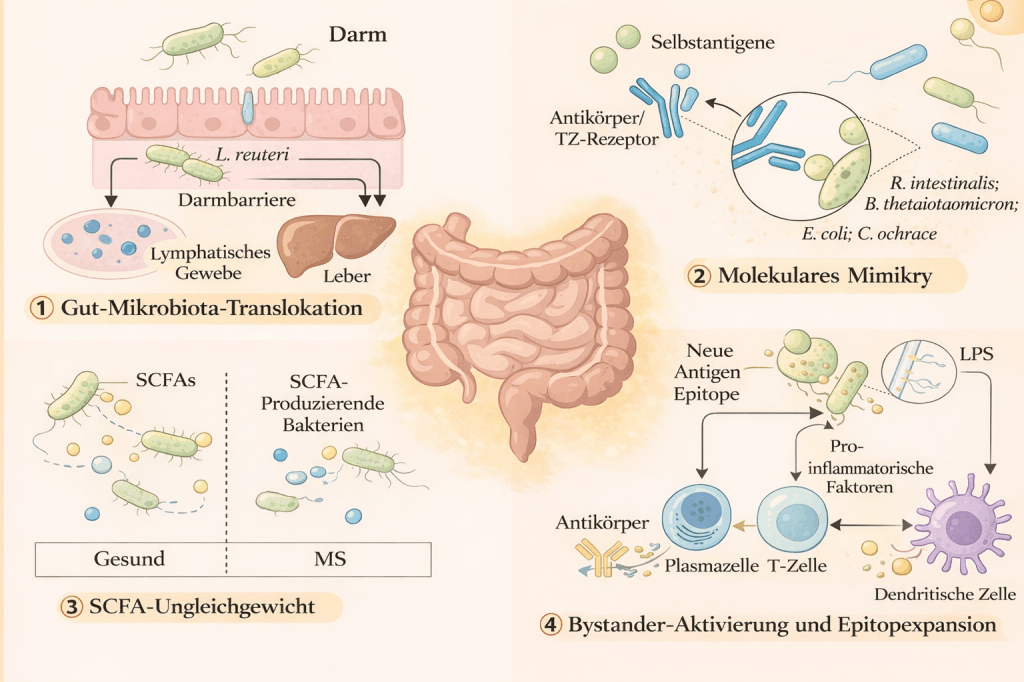
Die potenziellen pathogenen Mechanismen der Darmmikrobiota bei Autoimmunerkrankungen nach [1].
Was verändert sich im Darm bei MS?
Wenn wir über Darmgesundheit sprechen, meinen wir mehr als eine beschwerdefreie Verdauung. In unserem Darm lebt ein komplexes Ökosystem aus Billionen von Mikroorganismen – Bakterien, Viren und Pilzen –, das wir als Mikrobiota bezeichnen. Dieses System steht in engem Austausch mit unserem Immunsystem.
Das aktuelle Review von 2026 zeigt: Bei Autoimmunerkrankungen, zu denen auch die Multiple Sklerose zählt, finden sich wiederkehrende Veränderungen in der Zusammensetzung dieser Darmmikrobiota.
Man spricht hier von einer Dysbiose – also einem Ungleichgewicht zwischen schützenden und potenziell entzündungsfördernden Mikroorganismen.
Typisch ist eine geringere Diversität, das heißt: Die Vielfalt an Bakterienarten nimmt ab. Gleichzeitig treten bestimmte Stämme gehäuft auf, deren Vorkommen teilweise mit der Krankheitsaktivität korreliert. Einfach gesagt: Je aktiver die Erkrankung, desto deutlicher scheint sich auch das mikrobielle Muster zu verschieben.
Warum ist das relevant? Weil unser Darm kein isoliertes Organ ist. Etwa 70 Prozent unserer Immunzellen befinden sich in der Darmschleimhaut. Wenn sich dort das ökologische Gleichgewicht verändert, beeinflusst das direkt die Art und Weise, wie unser Immunsystem reagiert.
MS ist damit kein reines „Gehirnproblem“. Sie betrifft zwar das zentrale Nervensystem – also Gehirn und Rückenmark –, doch immunologische Prozesse, die im Darm angestoßen oder moduliert werden, prägen diese Entzündungen mit.
SCFA – kleine Moleküle mit großer Wirkung
Ein zentraler Mechanismus betrifft sogenannte kurzkettige Fettsäuren (englisch: short-chain fatty acids, SCFA). Dazu zählen insbesondere Acetat, Propionat und Butyrat. Diese entstehen, wenn Darmbakterien Ballaststoffe aus pflanzlicher Nahrung abbauen.
SCFA erfüllen mehrere wichtige Aufgaben:
- Sie wirken entzündungshemmend.
- Sie fördern sogenannte regulatorische T-Zellen (Treg-Zellen), die überschießende Immunreaktionen bremsen.
- Sie stabilisieren die Darmbarriere, also die Schutzschicht zwischen Darminhalt und Blutkreislauf.
Wenn SCFA-produzierende Bakterien reduziert sind – etwa durch Dysbiose oder wiederholte Antibiotikagaben – sinkt die Produktion dieser schützenden Metaboliten (Stoffwechselprodukte). Das Immunsystem gerät leichter in eine entzündliche Schieflage.
Für MS wird ein vergleichbares Muster angenommen: Weniger SCFA, weniger immunologische Bremsmechanismen, mehr entzündliche Aktivität.
Wir können uns das bildlich vorstellen wie ein Auto ohne funktionierende Bremsen. Das Gaspedal – also entzündliche Signale – ist weiterhin aktiv. Doch das Bremssystem, das normalerweise regulierend eingreift, arbeitet nicht mehr ausreichend oder versagt ganz.
Siehe auch: Die wichtige Rolle der Propionsäure bei der Behandlung von Multipler Sklerose | Life-SMS
„Leaky Gut“ – wenn die Darmbarriere durchlässig wird
Ein weiterer Begriff, der häufig fällt, ist „Leaky Gut“, wörtlich übersetzt: „durchlässiger Darm“. Normalerweise bildet die Darmschleimhaut eine hochspezialisierte Barriere. Sie lässt Nährstoffe passieren, hält aber Bakterienbestandteile und Toxine zurück. Wenn diese Barriere geschwächt ist, können mikrobielle Fragmente in den Blutkreislauf gelangen.
Das Immunsystem reagiert darauf mit Aktivierung – schließlich interpretiert es diese Bestandteile als potenzielle Bedrohung. Eine chronische, niedriggradige Entzündung kann die Folge sein.
Gerade bei Autoimmunerkrankungen wird dieses Konzept intensiv diskutiert. Denn wenn ständig immunologische Alarmreaktionen ausgelöst werden, steigt die Wahrscheinlichkeit, dass sich das Immunsystem gegen körpereigene Strukturen richtet.
Molekulares Mimikry – Verwechslung mit Folgen
Ein besonders spannender Mechanismus in diesem Zusammenhang ist das sogenannte molekulare Mimikry. Dabei ähneln bestimmte bakterielle Eiweißstrukturen körpereigenen Geweben. Das Immunsystem bildet Antikörper oder aktiviert T-Zellen gegen diese bakteriellen Strukturen – und greift versehentlich auch körpereigene Zellen an. Im Kontext der MS betrifft das vor allem Strukturen des zentralen Nervensystems, etwa Myelin – die schützende Hülle der Nervenfasern.
Wir sehen hier ein Prinzip, das wir aus anderen Autoimmunerkrankungen kennen: Ein eigentlich sinnvolles Abwehrsystem gerät durch Fehlsteuerung außer Kontrolle.
T-Zellen im Ungleichgewicht
Ein weiterer wichtiger Aspekt ist das Gleichgewicht zwischen verschiedenen Typen von T-Zellen. Diese Immunzellen steuern maßgeblich Entzündungsprozesse.
- Th17-Zellen fördern Entzündungen.
- Treg-Zellen wirken regulierend und bremsend.
Bei Dysbiose kann es zu einer Verschiebung zugunsten entzündungsfördernder Th17-Zellen kommen. Gleichzeitig fehlen ausreichende regulatorische Impulse.
Dieses Ungleichgewicht spielt auch im MS-Tiermodell eine zentrale Rolle. Das bedeutet nicht, dass der Darm allein die Erkrankung verursacht. Aber er kann immunologische Weichen stellen.
Probiotika – können „gute“ Bakterien helfen?
Vor diesem Hintergrund stellt sich die Frage: Können wir gezielt eingreifen?
Probiotika enthalten lebende Mikroorganismen, meist Lactobacillus- oder Bifidobacterium-Stämme. Diese können entzündliche Botenstoffe reduzieren, SCFA-Spiegel erhöhen und regulatorische T-Zellen fördern.
Für MS existieren bislang nur wenige größere kontrollierte Studien. Die Mechanismen erscheinen jedoch plausibel. Das bedeutet: Es gibt eine wissenschaftliche Grundlage, aber noch keine endgültige therapeutische Empfehlung. Die Einnahme von Probiotika bedeutet eine Chance bei der selbstverantwortlichen Behandlung der MS und wird hoffentlich auch in Ergänzung zu etablierten MS-Therapien als ergänzende Strategie Bedeutung gewinnen.
Präbiotika – Futter für die richtigen Bakterien
Während Probiotika lebende Bakterien zuführen, liefern Präbiotika deren „Nahrung“. Dabei handelt es sich meist um Ballaststoffe wie Inulin oder Fructooligosaccharide.
Diese werden vom Menschen nicht verdaut, dienen aber nützlichen Darmbakterien als Substrat. Die Folge:
- Förderung von Bifidobakterien und Laktobazillen
- Erhöhung der SCFA-Produktion
- Reduktion entzündlicher Zytokine wie IL-1, IL-6 und TNF-α
- Steigerung des antiinflammatorischen IL-10
Auch hier gilt: Direkte MS-Daten sind begrenzt. Doch die immunologischen Prinzipien sind übertragbar.
Siehe auch: Prä-, Pro- und Postbiotika: Eine Begriffsbestimmung, nicht nur für MS-Betroffene | Life-SMS
Fäkale Mikrobiota-Transplantation (FMT) – Reset für den Darm?
Die wohl radikalste Intervention ist die fäkale Mikrobiota-Transplantation. Dabei wird die Darmmikrobiota eines gesunden Spenders auf einen Patienten übertragen.
In anderen Autoimmunerkrankungen wie Typ-1-Diabetes oder Lupus konnten Entzündungsmarker gesenkt und SCFA-Produzenten angereichert werden.
Für MS fehlen bislang größere kontrollierte Studien. Es gibt aber sehr gute Ergebnisse aus kleineren Studien. Wir berichteten darüber schon:
Klingt unappetitlich, kann aber sehr wirksam bei MS sein: Fäkaltransplantation | Life-SMS
Ernährung – der pragmatische Ansatz im Alltag
Am unmittelbarsten beeinflussbar ist unsere Ernährung.
Das Review hebt insbesondere die mediterrane Ernährung hervor: viel Gemüse, Hülsenfrüchte, Vollkornprodukte, Nüsse, Olivenöl, wenig rotes Fleisch. Dieses Ernährungsmuster erhöht förderliche Bakteriengruppen, steigert SCFA und wirkt antiinflammatorisch.
Besonders relevant scheint der Salzkonsum. Eine hohe Salzaufnahme kann bestimmte Laktobazillen reduzieren, Th17-Zellen fördern und autoimmune Entzündungsprozesse verstärken.
Wir sehen hier einen klaren Zusammenhang: Ernährung beeinflusst die Mikrobiota – und diese beeinflusst wiederum das Immunsystem.
Das bedeutet nicht, dass Ernährung MS „heilt“. Aber sie kann das immunologische Milieu mitgestalten.
Was bedeutet das nun konkret für Menschen mit MS?
Zunächst einmal: Der Darm ist kein isoliertes Verdauungsorgan, sondern ein aktiver Teil unseres Immunsystems. Wenn sich die Zusammensetzung der Mikrobiota verändert, kann sich auch die Art verändern, wie Immunzellen reagieren. Eine Dysbiose – also ein Ungleichgewicht der Darmflora – kann entzündliche Prozesse begünstigen, während eine stabile, vielfältige Mikrobiota regulierend wirkt.
Für den Alltag heißt das, dass wir die Darmgesundheit als einen Schlüsselfaktor bei der Behandlung der MS verstehen müssen. Das gilt als Ergänzung zu Standardtherapien als auch unabhängig davon betrachtet. Die genannten Maßnahmen helfen das immunologische Umfeld zusätzlich zu stabilisieren. Eine ballaststoffreiche, pflanzenreiche, eher salzarme Ernährung ergänzt durch fermentierte Lebensmittel fördert SCFA-produzierende Bakterien und unterstützt regulatorische Immunmechanismen.
Gleichzeitig ist es sinnvoll, unnötige Antibiotikagaben kritisch zu hinterfragen, da sie schützende Keime reduzieren.
Probiotika, Präbiotika oder sogar mikrobiom-basierte Therapien wie die fäkale Transplantation gelten als vielversprechende Ansätze, befinden sich bei MS jedoch noch in einem frühen Stadium der klinischen Bewertung. Wir bewegen uns hier also in einem Feld zwischen solider biologischer Plausibilität und noch begrenzter klinischer Evidenz. An dieser Stelle ist die Natur- und Erfahrungsheilkunde schon deutlich weiter.
Für Betroffene bedeutet das vor allem eines: Die Darmgesundheit ist ein beeinflussbarer Faktor. Sie unterstützt jede neurologische Therapie, und muss Teil eines ganzheitlichen, selbstbestimmten Umgangs mit der Erkrankung sein.
Quelle:
[1] Zeng L, Yang Q, Luo Y, Luo Y, Sun L. The Gut Microbiota: Emerging Evidence in Autoimmune and Inflammatory Diseases. Research (Wash D C). 2026 Feb 4;9:1097. doi: 10.34133/research.1097. PMID: 41647244; PMCID: PMC12868559. / https://pubmed.ncbi.nlm.nih.gov/41647244/ (CC BY 4.0 Creative Commons Attribution License)
Bild:
Nach [1]: Die potenziellen pathogenen Mechanismen der Darmmikrobiota bei Autoimmunerkrankungen. Die Darmmikrobiota beeinflusst Autoimmunerkrankungen durch mehrere Mechanismen. Bakterien wie E. gallinarum und L. reuteri können in lymphatische Gewebe und die Leber wandern und dort Immunreaktionen und die Produktion von Autoantikörpern auslösen. Einige mikrobielle Antigene ähneln den Selbstantigenen des Wirts, was zu Kreuzreaktivität und Autoimmunreaktionen führt (Molekulares Mimikry). SCFAs, die von Darmbakterien produziert werden, regulieren die Immunität, werden jedoch durch Antibiotika reduziert, was sich auf Erkrankungen wie RA auswirkt. Entzündliche Umgebungen fördern auch die Aktivierung von T-Zellen, was zur Produktion von Autoantikörpern führt.
Original: https://pmc.ncbi.nlm.nih.gov/articles/PMC12868559/figure/F1/ (CC BY 4.0 Creative Commons Attribution License)
Und wenn Sie helfen wollen, dass Life-SMS Ihnen weiterhin wertvolle Informationen bereitstellen kann, dass unser Projekt weiterlebt, unterstützen Sie uns über drei einfache Wege!
 |
 |

Du muss angemeldet sein, um einen Kommentar zu veröffentlichen.