von Kirsten

Da hat man schon eine nervige Erkrankung! Und dann gesellen sich im Laufe der Zeit auch noch Knochenstoffwechselstörungen wie Osteoporose dazu. Muss es denn so weit kommen?
Gemäss Fachliteratur haben MS-Erkrankte ein bis zu 10-fach (!) erhöhtes Osteoporose-Risiko gegenüber nicht Erkrankten [1]. Auch Knochenbrüche sind gemäss Studienlage bei MS-Erkrankten häufiger vorzufinden. So bestehe beispielsweise ein 3-fach erhöhtes Risiko, eine Hüftfraktur zu erleiden, im Vergleich zu nicht Erkrankten [1].
Aber wieso wird der Knochenstoffwechsel gestört? Wieso werden die Knochen weich (Osteomalazie), porös (Osteoporose) bzw. brüchig, wenn man doch eigentlich eine Nervenerkrankung hat? Und ist Osteoporose nicht eigentlich eine Alterserscheinung?
Die Osteoporose z.B. wird (anders als die «primäre» altersbedingte Osteoporose) bei MS-Erkrankten als «sekundäre» Osteoporose beschrieben (also als «Folge» der MS-Erkrankung). Sie wird allerdings nicht primär auf geschädigte Nerven, sondern vielmehr auf verschiedene Lebensumstände zurückgeführt, die den Knochenabbau fördern.
Körperliche Bewegung
Bewegungsmangel gilt im Allgemeinen als eine potenzielle Ursache der MS-begleitenden Osteoporose. Denn der Reiz, der das Knochenwachstum fördert, wird von der Muskulatur gegeben. Bewegt man sich nicht ausreichend, wird dieser Reiz nicht genügend erzeugt und das Gleichgewicht aus Knochenab- und Knochenaufbau verschiebt sich zu Ungunsten der Knochengesundheit. Die Elastizität der Knochen wird gemindert, so dass diese schneller unter Belastung brechen.
Für alle MS-Erkrankten, die körperlich nicht bzw. kaum eingeschränkt sind, wäre daher regelmässige Bewegung anzuraten. Das fängt schon an mit Spaziergängen, Feldenkrais, Yoga, Beckenboden-Training, Wassergymnastik, sportlicher Betätigung bis hin zum Ausdauertraining oder gezielten Muskelaufbau. Auch Koordinationstraining auf Balance-Boards oder speziellen Balance-Kissen (sofern Ihre Koordinationsfähigkeiten nicht allzu stark gemindert sind) unterstützt den Erhalt der Knochengesundheit. Im Alltag kann auch der Einsatz von Hilfsmitteln (wie z.B. Balance-Kissen auf dem Stuhl beim Sitzen) helfen, dem Knochenabbau etwas entgegenzuwirken.
Für Erkrankte, die körperlich stärker eingeschränkt sind, sind Physiotherapeuten bzw. Sportwissenschaftler im therapeutischen Bereich eine gute Anlaufstelle. Unterstützenden Muskelaufbau könnten Sie auch mit EMS-Training (EMS=Elektromyostimulation) in Absprache mit Ihrem Therapeuten erreichen. Wenn genügend Muskulatur vorhanden ist und Sie keine künstlichen Gelenke haben bzw. an Gelenkproblemen wie Arthrose leiden, könnte (in Absprache mit Ihrem Therapeuten) womöglich Vibrationstraining in Betracht gezogen werden [2], [3]. Für Rollstuhlfahrer gibt es inzwischen sogar spezielle Vibrationsvorrichtungen – wenn auch leider zu bisher nicht überschaubaren Preisen [4], [5]. Für Privatpersonen wäre eine solche Trainingsplatte wohl sehr kostenintensiv. Aber manche Therapeuten bieten Vibrationstraining an, so dass diese hierfür eine mögliche Anlaufstelle wären. Insgesamt gilt: Halten Sie sich bitte an die Anweisung Ihres behandelnden Therapeuten und an die Herstellervorschriften.
| Mehr zum Thema: Vibrationstraining verbessert den Behinderungsgrad bei Multipler Sklerose: Ergebnisse einer Pilotstudie |
Des Weiteren könnte regelmässige Hippotherapie durchgeführt werden. Hierbei erfolgt eine Bewegungsübertragung des sich bewegenden (und speziell dafür ausgebildeten) Pferdes auf den darauf sitzenden Patienten – wodurch letztendlich die Muskulatur des Patienten trainiert wird. Bitte wenden Sie sich an Ihre Krankenkasse, ob diese die Kosten einer solchen Therapie übernimmt.
Seit etwa 20 Jahren wird in den USA u.a. Magnetfeldtherapie zur Behandlung von Knochenbrüchen eingesetzt [6]. In Deutschland wurde sie zur Behandlung von Schmerzen vor 10 Jahren als IGeL-Leistung eingestuft [7]. Neueste Forschung weist aber auf eine vermehrte Expression eines bestimmten Proteins (Wachstumsfaktor für Knochengewebe) hin, das durch die Magnetfeldtherapie induziert wird [8]. Verschiedene Studien zeigten prinzipiell gute Erfolge dieser Therapiemethode bei Osteoporose [9], [10]. Gewöhnlich werden die Kosten für eine solche Therapie nicht von den gesetzlichen Krankenkassen übernommen, können dort aber sicherlich angefragt werden.
Mikronährstoffe
Begünstigt wird eine Abnahme der Knochengesundheit auch durch niedrige Vitamin-D-Werte. Denn Vitamin D ist sehr wichtig für den Knochenstoffwechsel, indem es die Aufnahme von Calcium und Phosphat aus dem Darm sowie deren Einbau in den Knochen fördert. Wird weniger Knochensubstanz auf- als abgebaut, kommt es auch hier wieder zu Störungen des Knochenstoffwechsels. Ein ausgeprägter Vitamin-D-Mangel zeigt sich im Erwachsenenalter u.a. in Osteomalazie, also der schmerzhaften Erweichung der Knochen. Bei Kindern würde sie sich in Form von Rachitis zeigen. Vitamin-D-Mangel äussert sich zudem in Muskelschwäche – was wiederum das Risiko, hinzufallen und sich dabei möglicherweise Knochen zu brechen, erhöht [11].
Für die Umwandlung des mit der Nahrung aufgenommenen Vitamin-D-Derivats in seine biologisch aktive Form (auch «Vitamin D3» genannt), braucht es u.a. Magnesium. Eine ausreichende Magnesium-Versorgung ermöglicht also, dass das Vitamin D seine Aufgabe im Knochenstoffwechsel bestmöglich ausführen kann.
Körpereigene Stoffe wie z.B. Homocystein scheinen den Knochenabbau voranzutreiben. Als einen möglichen therapeutischen Ansatz wird diesbezüglich der Einsatz von B-Vitaminen (insbesondere von Vitamin B12 und Folsäure) beschrieben [12]. Denn diese bauen (die für die Knochen toxische Substanz) Homocystein ab. Der Benefit einer B-Vitamine-Supplementierung auf die Knochengesundheit wurde bisher nur bei Personengruppen beschrieben, deren B-Vitamin-Werte niedrig waren – nicht aber bei Personengruppe, die bereits ausreichend hohe Werte aufwiesen [13]. Das Vermeiden eines Vitamin-B12- bzw. Folsäure-Mangels scheint also auch der Knochengesundheit förderlich zu sein.
Eine zuckerarme Ernährung scheint auch der Knochengesundheit ebenfalls dienlich zu sein. Denn Zuckerkonsum begünstige – Untersuchungen nach – zum einen eine erhöhte Ausscheidung von Calcium und Magnesium über den Urin [14]. Zum anderen würde die Aufnahme von Calcium und Vitamin D im Darm gehemmt. Beides würde die Knochengesundheit beeinträchtigen. Zudem scheinen Dysregulierungen im Glucosestoffwechsel (z.B. bei Insulinresistenz oder Diabetes) die Aktivität der knochenreparierenden Osteoblasten zu stören und gleichzeitig die der knochenabbauenden Osteoclasten zu erhöhen [15].
Eine Versorgung mit Calcium ist lebenswichtig. Wir nehmen es täglich in einer Vielzahl verschiedener Lebensmittel auf – v.a. in Form von Milchprodukten und (kalkhaltigem) Trinkwasser [16]. Eine Unterversorgung erscheint bei normaler Ernährung wenig wahrscheinlich – und kann i.d.R. folglich vermieden werden, wenn es keine akuten Umstände gibt, die eine zusätzliche Calcium-Zufuhr erfordern. Während der Stosstherapie z.B. werden Sie gewöhnlich von Ihrem behandelnden Arzt mit Calcium- und Vitamin-D-Präparaten versorgt. Wichtig ist generell: Achten Sie vor allem auf eine genügende Bildung bzw. Zufuhr von Vitamin D und Magnesium!
Medikamente und Stress
Der Knochenabbau wird u.a. auch auf verschiedene Medikamente zurückgeführt. Insbesondere fördern Glucocorticoid-haltige Medikamente (wie sie z.B. hochdosiert in der Stosstherapie verabreicht werden) Osteoporose [17], [18] [19]. Ebenso erhöhen auch Antiepileptika das Osteoporose-Risiko [20]. Gemäss wissenschaftlicher Literatur werden Nebenwirkungen der Glucocorticoide-Therapie wie erhöhtes Osteoporose-Risiko (sowie erhöhtes Diabetesrisiko, Bluthochdruck, Herzbeschwerden oder Infektionen) ab einer täglichen Dosis von 5 mg Prednisolon (ein Glucocorticoid) pro Tag beschrieben – insbesondere bei einer länger dauernden Therapie [21]. Eine andere Quelle beschreibt ein erhöhtes Risiko für Knochenbrüche ab einer täglichen Dosis von 2,5 mg Prednison [22] (Vorstufe des Prednisolon [23]).
Seit vielen Jahren heisst es, dass die Stosstherapie keinen nennenswerten Effekt auf die Knochendichte haben würde [24], [25]. Als Erklärung findet man immer wieder, dass die Glucocorticoide zwar in sehr hohen Dosen, aber dafür nur kurzzeitig verabreicht werden. Da die Knochendichte zur Bestimmung des Osteoporose-Grades verwendet wird [26], würde sich demzufolge das Osteoporose-Risiko nur bei Langzeiteinnahme der Medikamente erhöhen. Bei der Knochendichte-Messung werden Knochen z.B. an Lendenwirbelsäule und Oberschenkelhals mit Röntgenstrahlung bestrahlt. Man vergleicht die Röntgenstrahlung, die durch den Knochen durchkommt mit der, die eingestrahlt wurde – und zieht hieraus Schlüsse über den Kalksalzgehalt des Knochens, der häufig als Indiz der Knochengesundheit herangezogen wird.
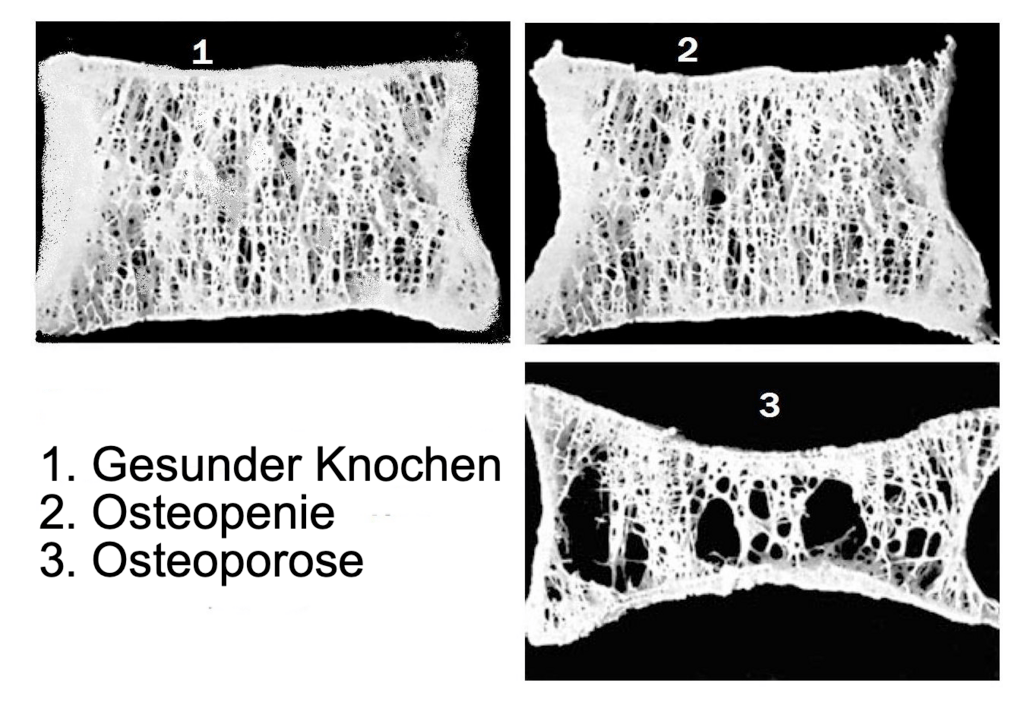
Schaut man sich jedoch die Mikroarchitektur des Knochens an, also die «trabekuläre Knochendichte», so findet man bereits nach einer (!) Stosstherapie (die üblicherweise 3-5 Tage mit 500-1000 mg Methylprednisolon durchgeführt wird) eine signifikante Verschlechterung gegenüber vorher [27]. Die schwammartige Netzstruktur im Inneren eines Knochens («trabekulärer» Knochen) bestimmt erheblich die Stabilität und Tragkraft des Knochens [28]. Wird diese Gerüststruktur (also die vielen Quervernetzungen im Knocheninneren) zerstört, wird der Knochen porös und das Frakturrisiko steigt. Hinweise: 5 mg Prednisolon würde einer Äquivalenz-Dosierung von 4 mg Methylprednisolon entsprechen [29]. Als «hohe» Dosierung gilt bereits 7.5 mg pro Tag [30].
Glukocortikoidhaltige Medikamente stören zudem den Vitamin D- und damit auch den Calciumstoffwechsel. Es kommt zu einer verminderten Aufnahme von Calcium und Phosphat im Darm und zu einer vermehrten Ausscheidung von Calcium, was wiederum zu einer vermehrten Demineralisation und zu einer ungenügenden Remineralisation des Knochens führt – um die Calciumwerte im Blut möglichst konstant zu halten.
Die Knochensubstanz wird hierdurch weicher und kann in eine Osteomalazie übergehen [31]. Zur Behandlung und Prävention der Osteomalazie wird vor allem Vitamin D verabreicht. Im Zusammenhang mit MS wurde bisher vor allem die Osteoporose (also eine Abnahme der Knochenmasse sowie eine Veränderung der Mikroarchitektur des Knochens) und kaum die Osteomalazie (also eine gestörte Mineralisierung der Knochensubstanz) untersucht. Beide führen zu einer verringerten Tragkraft der Knochen sowie zu deren leichterem Brechen.
Doch wie vermeidet man den Einsatz solcher Medikamente bzw. minimiert deren Nebenwirkungen auf die Knochen? Generell können bestimmte Lebensstilmassnahmen langfristig helfen, den Krankheitsverlauf positiv zu beeinflussen und somit den Einsatz potenziell knochenschädigender Medikamente zu reduzieren. Hierzu zählen, wie oben erwähnt, regelmässige körperliche Bewegung, ausreichende Versorgung mit Mikronährstoffen, das Vermeiden gesundheitsschädigender Einflüsse (z.B. durch Rauchen) sowie Stressreduktion. Denn Stress bedeutet erhöhte Cortisol- (also Glucocorticoid-) Werte und damit ein tendenziell erhöhtes Risiko des Knochenabbaus.
Besprechen Sie die Notwendigkeit einer hohen Dosierung sowie die Anwendungsdauer solcher Medikamente bitte vorher mit Ihrem Arzt. Möglicherweise wäre auch eine niedrigere Dosierung bzw. eine kürzere Therapiedauer ausreichend. Bereits seit einigen Jahrzehnten werden Glucocorticoide als Immunsuppressiva eingesetzt. Puls-/Stosstherapien wurden bereits in den 1970er Jahren mit einer Dosierung von 1000 mg (also 1 g) Methylprednisolon täglich beschrieben – nach Organtransplantationen, bei Lupus Nephritis oder rheumatoider Arthritis [32]. Diese Dosierung wurde zur Behandlung der MS übernommen – wenn für mich auch schwer nachvollziehbar ist, wie diese extrem hohe Dosierung überhaupt zustande kam.
Während der Stosstherapie erhalten Sie von Ihrem Arzt in der Regel Calcium- und Vitamin-D-Präparate. Doch benötigt der Körper auch in den darauffolgenden Wochen weiterhin Unterstützung beim Aufbau der Knochenmasse, die bedingt durch die Medikamente, reduziert wurde. Auch hier wieder: Bewegung, Stressreduktion, Mikronährstoffe wie Vitamin D und Magnesium und das Meiden weiterer Risikofaktoren (siehe unten).
Weitere Faktoren
Risikofaktoren von Osteoporose sind zudem Rauchen, regelmässiger Alkoholkonsum, Untergewicht sowie Hormonmangel [33]. Auch chronisch-entzündliche Darmerkrankungen werden mit einem erhöhten Osteoporose-Risiko assoziiert [34] – möglicherweise weil knochenaufbauende Substanzen nicht genügend vom Darm resorbiert werden können und weil auch hier u.a. Glucocorticoide als Therapie verabreicht werden, wenn auch in niedrigerer Dosierung, aber dafür länger als bei der Stosstherapie.
Fazit
Die Knochengesundheit gilt bei MS-Erkrankten als deutlich beeinträchtigt gegenüber nicht Erkrankten. Ursachen hierfür sind u.a. Bewegungsmangel, Medikamente, Stress sowie ungesunde Einflussfaktoren wie Rauchen oder häufiger Alkoholkonsum.
Die Knochengesundheit lässt sich positiv beeinflussen durch körperliche Bewegung, eine genügende Versorgung mit Mikronährstoffen (wie Vitamin D und Magnesium) und das Meiden ungesunder Lebens- bzw. Genussmittel (Zucker, Rauchen, häufiger Alkoholkonsum).
Referenzen
[1] O. Zimmermann and K. H. Stürner, ‘Osteoporose und Frakturen bei Multipler Sklerose – unterschätzt und ignoriert?’, Osteologie, vol. 28, no. 4, pp. 259–267, Nov. 2019, doi: 10.1055/a-1005-8190.
[2] ‘Vibrationstraining bei Osteoporose. Was hilft? Und warum?’ Accessed: Feb. 15, 2025. [Online]. Available: https://www.osd-ev.org/osteoporose-therapie/osteoporose-bewegung-sport/vibrationstraining/
[3] F. H. dpa, ‘Training mit Vibrationsplatte: Nicht für jeden geeignet’, Apotheken Umschau. Accessed: Feb. 15, 2025. [Online]. Available: https://www.apotheken-umschau.de/gesund-bleiben/sport-und-bewegung/training-mit-vibrationsplatte-797091.html
[4] ‘Galileo Vibrationsplatten Therapie bei Querschnittslähmung’, Galileo Vibrationsplatten – http://www.vplatte.de. Accessed: Feb. 15, 2025. [Online]. Available: http://www.vplatte.de/therapie/querschnittslähmung/
[5] ‘Whole Body Vertical Vibration for Wheelchair #BS1 – turtle gym’. Accessed: Feb. 15, 2025. [Online]. Available: https://de.turtlegymworld.com/portable-wheelchair-sport-platform-tpa-02.html
[6] ‘Pulsed electromagnetic field therapy’, Wikipedia. Jan. 09, 2025. Accessed: Feb. 15, 2025. [Online]. Available: https://en.wikipedia.org/w/index.php?title=Pulsed_electromagnetic_field_therapy&oldid=1268353565
[7] ‘IGeL Monitor – 2014-12-16 Magnetfeldtherapie ohne Nutzen und Schaden’. Accessed: Feb. 15, 2025. [Online]. Available: https://www.igel-monitor.de/presse/pressemitteilungen/magnetfeldtherapie-ohne-nutzen-und-schaden.html
[8] S. Ding, G. Zhang, Y. Gao, Z. Hou, and F. Shao, ‘Investigating the preventive effects of pulsed electromagnetic fields on glucocorticoid-induced osteoporosis in rats’, Sci. Rep., vol. 15, no. 1, p. 2535, Jan. 2025, doi: 10.1038/s41598-025-86594-8.
[9] W. Zhang et al., ‘The Possible Role of Electrical Stimulation in Osteoporosis: A Narrative Review’, Medicina (Mex.), vol. 59, no. 1, p. 121, Jan. 2023, doi: 10.3390/medicina59010121.
[10] ‘(PDF) Pulsed Electromagnetic Field Promotes Bone Anabolism in Postmenopausal Osteoporosis through the miR-6976/BMP/Smad4 Axis’, ResearchGate, Dec. 2024, doi: 10.1155/2023/8857436.
[11] J. W. Nieves, ‘Osteoporosis: the role of micronutrients’, Am. J. Clin. Nutr., vol. 81, no. 5, pp. 1232S-1239S, May 2005, doi: 10.1093/ajcn/81.5.1232.
[12] J. Narváez et al., ‘Role of homocysteine and vitamin B in bone metabolism’, Rev. Colomb. Reumatol. Engl. Ed., vol. 27, no. 4, pp. 278–285, Oct. 2020, doi: 10.1016/j.rcreue.2019.12.008.
[13] M. Clements et al., ‘A 2-Year Randomized Controlled Trial With Low-Dose B-Vitamin Supplementation Shows Benefits on Bone Mineral Density in Adults With Lower B12 Status’, J. Bone Miner. Res. Off. J. Am. Soc. Bone Miner. Res., vol. 37, no. 12, pp. 2443–2455, Dec. 2022, doi: 10.1002/jbmr.4709.
[14] J. J. DiNicolantonio, V. Mehta, S. B. Zaman, and J. H. O’Keefe, ‘Not Salt But Sugar As Aetiological In Osteoporosis: A Review’, Mo. Med., vol. 115, no. 3, pp. 247–252, 2018.
[15] C. M. Karner and F. Long, ‘Glucose metabolism in bone’, Bone, vol. 115, pp. 2–7, Oct. 2018, doi: 10.1016/j.bone.2017.08.008.
[16] ‘https://www.sge-ssn.ch/media/ct_protected_attachments/962ef4de9361090d489469910fbfe3/SGE_InfoFlash_Calcium_DE.pdf’. Accessed: Feb. 22, 2025. [Online]. Available: https://www.sge-ssn.ch/media/ct_protected_attachments/962ef4de9361090d489469910fbfe3/SGE_InfoFlash_Calcium_DE.pdf
[17] S. Gupta, I. Ahsan, N. Mahfooz, N. Abdelhamid, M. Ramanathan, and B. Weinstock-Guttman, ‘Osteoporosis and multiple sclerosis: risk factors, pathophysiology, and therapeutic interventions’, CNS Drugs, vol. 28, no. 8, pp. 731–742, Aug. 2014, doi: 10.1007/s40263-014-0173-3.
[18] A.-M. D. A. GmbH, ‘Glucocorticoide: Paradoxe Effekte auf den Knochen’, Pharmazeutische Zeitung online. Accessed: Feb. 15, 2025. [Online]. Available: https://www.pharmazeutische-zeitung.de/ausgabe-312013/paradoxe-effekte-auf-den-knochen/
[19] R. Schweiz, ‘Glucocorticoid-induzierte Osteoporose | Rheuma Schweiz’. Accessed: Feb. 15, 2025. [Online]. Available: https://rheuma-schweiz.ch/krankheitsbilder/fachbereiche/knochenerkrankungen/osteoporose/glucocorticoid-induzierte-osteoporose/
[20] ‘Meier and Kraenzlin – Epilepsie, Antiepileptika und Osteoporose.pdf’. Accessed: Feb. 15, 2025. [Online]. Available: https://www.epi.ch/wp-content/uploads/Artikel-Meier_1_11.pdf
[21] G. Keyßer, ‘Sicherheitsaspekte der Therapie mit Glukokortikoiden bei rheumatoider Arthritis’, Z. Rheumatol., vol. 80, no. 4, pp. 295–304, 2021, doi: 10.1007/s00393-021-00972-x.
[22] I. Ilias, C. Milionis, and E. Zoumakis, ‘An Overview of Glucocorticoid-Induced Osteoporosis’, in Endotext, K. R. Feingold, B. Anawalt, M. R. Blackman, A. Boyce, G. Chrousos, E. Corpas, W. W. de Herder, K. Dhatariya, K. Dungan, J. Hofland, S. Kalra, G. Kaltsas, N. Kapoor, C. Koch, P. Kopp, M. Korbonits, C. S. Kovacs, W. Kuohung, B. Laferrère, M. Levy, E. A. McGee, R. McLachlan, M. New, J. Purnell, R. Sahay, A. S. Shah, F. Singer, M. A. Sperling, C. A. Stratakis, D. L. Trence, and D. P. Wilson, Eds., South Dartmouth (MA): MDText.com, Inc., 2000. Accessed: Feb. 21, 2025. [Online]. Available: http://www.ncbi.nlm.nih.gov/books/NBK278968/
[23] ‘Prednisolon vs. Prednison’, Rettungsdienst FactSheets. Accessed: Feb. 21, 2025. [Online]. Available: https://rd-factsheets.de/prednisolon-vs-prednison/
[24] B. Frediani et al., ‘Effects of High Dose Methylprednisolone Pulse Therapy on Bone Mass and Biochemical Markers of Bone Metabolism in Patients with Active Rheumatoid Arthritis: A 12-Month Randomized Prospective Controlled Study’, J. Rheumatol..
[25] S. Zengin Karahan et al., ‘Lack of Association between Pulse Steroid Therapy and Bone Mineral Density in Patients with Multiple Sclerosis’, Mult. Scler. Int., vol. 2016, p. 5794910, 2016, doi: 10.1155/2016/5794910.
[26] ‘Knochendichte’, Wikipedia. Jan. 25, 2025. Accessed: Feb. 21, 2025. [Online]. Available: https://de.wikipedia.org/w/index.php?title=Knochendichte&oldid=252610533
[27] J. Rymuza, K. Pelewicz, J. Przedlacki, and P. Miśkiewicz, ‘Therapy With Intravenous Methylprednisolone Pulses Is Associated With Loss of Bone Microarchitecture in Trabecular Bone Score -Assessment Among Patients With Moderate-to-Severe Graves’ Orbitopathy: A Pilot Study’, Front. Endocrinol., vol. 13, Jul. 2022, doi: 10.3389/fendo.2022.893600.
[28] ‘Osteoporose – Was ist Knochenqualität?’ Accessed: Feb. 15, 2025. [Online]. Available: https://www.osd-ev.org/osteoporose/bni/was-ist-knochenqualitaet/
[29] ‘Prednisolon’, Wikipedia. Jan. 12, 2025. Accessed: Feb. 15, 2025. [Online]. Available: https://de.wikipedia.org/w/index.php?title=Prednisolon&oldid=252193423#%C3%84quivalenzdosen
[30] M. R. Laurent et al., ‘Prevention and Treatment of Glucocorticoid-Induced Osteoporosis in Adults: Consensus Recommendations From the Belgian Bone Club’, Front. Endocrinol., vol. 13, p. 908727, Jun. 2022, doi: 10.3389/fendo.2022.908727.
[31] L. Cianferotti, ‘Osteomalacia Is Not a Single Disease’, Int. J. Mol. Sci., vol. 23, no. 23, Art. no. 23, Jan. 2022, doi: 10.3390/ijms232314896.
[32] R. Berkovich, ‘Treatment of acute relapses in multiple sclerosis’, Neurother. J. Am. Soc. Exp. Neurother., vol. 10, no. 1, pp. 97–105, Jan. 2013, doi: 10.1007/s13311-012-0160-7.
[33] ‘Osteoporose’, Wikipedia. Jan. 15, 2025. Accessed: Feb. 15, 2025. [Online]. Available: https://de.wikipedia.org/w/index.php?title=Osteoporose&oldid=252289557
[34] D. Ä. G. Ärzteblatt Redaktion Deutsches, ‘Chronisch-entzündliche Darmerkrankungen: Schon bei Erstdiagnose liegt oft eine Osteopenie vor’, Deutsches Ärzteblatt. Accessed: Feb. 15, 2025. [Online]. Available: https://www.aerzteblatt.de/archiv/chronisch-entzuendliche-darmerkrankungen-schon-bei-erstdiagnose-liegt-oft-eine-osteopenie-vor-bd4c3daa-7d10-4d08-ad5f-15044a3c07e8
Bildquellen
OpenAI (2025). Knochengesundheit bei MS [AI-generated infographic]. Created using ChatGPT and DALL·E. https://chat.openai.com
Partynia, CC BY-SA 4.0, https://creativecommons.org/licenses/by-sa/4.0, via Wikimedia Commons
Und wenn Sie helfen wollen, dass Life-SMS Ihnen weiterhin wertvolle Informationen bereitstellen kann, dass unser Projekt weiterlebt, unterstützen Sie uns über drei einfache Wege!
 |
 |



Du muss angemeldet sein, um einen Kommentar zu veröffentlichen.